*Por Marcelo Sicoli
O mercado de produtos e equipamentos médicos no Brasil, estimado em quase R$ 8 bilhões(US$ 4,5 bilhões), está em expansão. Depois de um crescimento de 6% em 2009, na comparação com 2008, deve aumentar mais 10% em 2010, segundo estimativas da ABIMO – Associação Brasileira da Indústria de Artigos e Equipamentos Médicos, Odontológicos, Hospitalares e de Laboratórios. O otimismo da indústria leva em conta as perspectivas de crescimento do País que deve ultrapassar 6% este ano. No mercado farmacêutico por exemplo, a expectativa é que haja um crescimento de 13% em 2010.
 Os números da balança comercial do setor mostram que em 2009, as exportações somaram pouco mais de US$ 500 milhões, enquanto que as importações ultrapassaram US$ 2,7 bilhões; um déficit significativo. O setor público representou 21,5% das compras, o setor privado 68,6% e as exportações 8,8%. A constatação que o Brasil já é um importante ator ganha força no mercado internacional. No ano passado, efetivou negócios com compradores da Ucrânia, Polônia, Servia, Romênia e Moldávia e registrou mais de 3 mil contatos com representantes de 108 países na maior feira dirigida ao setor médico-hospitalar, que aconteceu na Alemanha. No entanto, os principais compradores são os Estados Unidos(25,8%), Argentina (8,1%) e México (6,9%). O Brasil possui cerca de 500 fabricantes de equipamentos médicos, hospitalares e odontológicos. As indústrias de médio porte representam 52,20% e as micro ou pequenas respondem por 25,7%
Os números da balança comercial do setor mostram que em 2009, as exportações somaram pouco mais de US$ 500 milhões, enquanto que as importações ultrapassaram US$ 2,7 bilhões; um déficit significativo. O setor público representou 21,5% das compras, o setor privado 68,6% e as exportações 8,8%. A constatação que o Brasil já é um importante ator ganha força no mercado internacional. No ano passado, efetivou negócios com compradores da Ucrânia, Polônia, Servia, Romênia e Moldávia e registrou mais de 3 mil contatos com representantes de 108 países na maior feira dirigida ao setor médico-hospitalar, que aconteceu na Alemanha. No entanto, os principais compradores são os Estados Unidos(25,8%), Argentina (8,1%) e México (6,9%). O Brasil possui cerca de 500 fabricantes de equipamentos médicos, hospitalares e odontológicos. As indústrias de médio porte representam 52,20% e as micro ou pequenas respondem por 25,7%
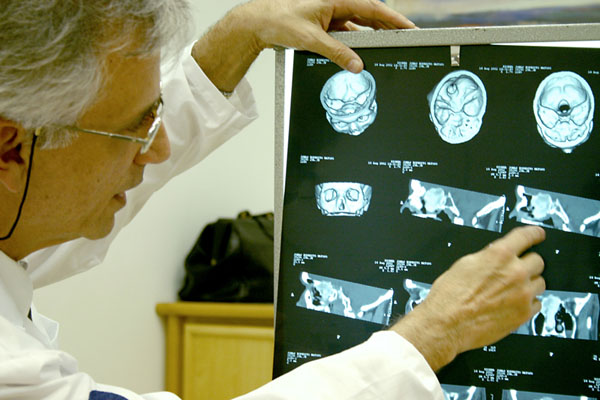
Os materiais de O.P.M.E – Órteses, Próteses e Materiais Especiais – utilizados em intervenções médicas, representam até 80% do total da conta hospitalar. O avanço tecnológico nessa área tem sido notável, principalmente em algumas especialidades como cirurgias de coluna, ortopédicas e cardiovasculares.
Desde maio de 2010, todas as petições de solicitação de registro, revalidação e alterações pós-registro de produtos passaram a ter que apresentar protocolo de Certificação de Boas Práticas de Fabricação e Controle (CBPFC) emitidos pela Agência Nacional de Vigilância Sanitária – ANVISA. Antes, a apresentação do certificado era restrita a medicamentos. É de competência da própria Agência avaliar o sistema de qualidade dos fabricantes de equipamentos e produtos médicos e conceder a sua certificação. Hoje cerca de 85% dos processos de registro de equipamentos médicos e implantes ortopédicos não são aprovados na primeira solicitação; recebem pelo menos uma exigência por estarem mal-instruídos. Os motivos podem ser a ausência de um documento, de um teste ou até mesmo a falta de clareza na prestação das informações. A Anvisa no entanto, tenta acelerar os processos de concessão de registro, garantindo maior agilidade e competitividade entre as empresas.
Segundo Glauco Santos, diretor da empresa de assuntos regulatórios Register Brasil : “Em virtude do grande crescimento deste setor no País, tanto os fabricantes nacionais quanto os internacionais estão cada vez mais interessados em expandir o seu crescimento, seja melhorando a qualidade da fabricação de seus produtos, seja analisando a possibilidade de possuir uma base de produção instalada no Brasil. Em um mercado que muitas vezes não possui uma concorrência no nível de qualidade e tecnologia necessária, as empresas estrangeiras estão cada vez mais ganhando espaço no mercado nacional.”
É importante destacar que a resolução normativa da ANS (Agência Nacional de Saúde) – RN 211 de Janeiro de 2010, atualizou o rol de procedimentos e eventos que os planos de saúde estão obrigados a cobrir, incluindo os produtos de alto custo como os de OPME. Ela entrou em vigor em junho de 2010, com a inclusão de exames como a PET-scan (Tomografia por emissão de Positrons), a oxigenoterapia hiperbárica e a capilaroscopia periungueal. A RN 211, adicionou 54 procedimentos para os planos de saúde médico-hospitalares e 16 procedimentos para os planos odontológicos, totalizando um conjunto de mais de 3000 procedimentos. Isto obriga os hospitais e clínicas a se atualizarem e adequarem.
No que tange a aquisição de produtos farmacêuticos, o Ministério da Saúde que baseia suas compras em menor preço, tem mudado a metodologia justamente para evitar comprar produtos de baixa qualidade oriundos especialmente de países em desenvolvimento asiáticos. O conteúdo local, tem se tornado cada vez mais importante nesta decisão. Tendência similar tem acontecido com o setor de equipamentos médicos.
Os produtos fabricados no Brasil, passam por um controle de qualidade muito mais rigoroso, mas, por outro lado, evitam as elevadas tarifas de importação e aproveitam da maior proximidade com o mercado consumidor. Há um grande potencial para empresas internacionais, uma vez que muitos desses produtos ainda vêm de outros países.
*Marcelo Sicoli e Thaise Mrad, consultores da Enterbrazil
E-mail: contact@enterbrazil.com